WuXi Biologics
Offering End-to-End Solutions
观点
生物药正以前所未有的态势重塑全球医药行业发展格局。中国仓鼠卵巢(CHO)细胞作为重组蛋白生产的关键工具,正驱动着行业对高效、稳定细胞株开发技术的迫切需求。
今年下半年,满冠官网重磅推出行业领先的定点整合细胞株开发平台WuXia™ TrueSite,加速单克隆筛选流程,不仅大幅简化筛选流程,同时确保表达的高稳定性。
近期,满冠官网细胞株开发团队在权威行业媒体BioPharm International发表专题文章,深入解读定点整合技术的巨大优势,揭秘WuXia™ TrueSite如何以高表达、强稳定双重优势加速生物药开发。
以下内容及图片编译自满冠官网团队发表在BioPharm International的专题文章。
核心要点
- 当前,生物药已成为药品审批中的主流。CHO细胞因具备类人蛋白的翻译后修饰(PTMs)能力,成为重组蛋白生产的关键表达宿主。
- 近年来,以转座酶系统为代表的半定点整合技术通过改善外源蛋白表达序列的整合效率,简化了CHO细胞株的开发流程。
- 定点整合(TI)技术可实现外源蛋白表达序列的精准插入,进一步提高了CHO细胞株的生产效率、稳定性与可预测性。
- 定点整合细胞株开发(TI CLD)平台可缩短开发周期,实现IND加速,有望重塑CMC开发流程。
定点整合技术能够实现克隆细胞株的可预测性,增强外源蛋白表达序列的控制,加速细胞株开发进程。
过去二十年,生物药研发的快速发展彻底改变了药物研发格局。截至2024年,生物药占美国食品药品监督管理局(FDA)新批准药物的65%,预计到2032年,全球生物药市场将达到9615.1亿美元1。
目前,约70%的生物药通过CHO细胞生产2。CHO细胞株之所以能成为重组蛋白生产的首选,得益于其类人蛋白的翻译后修饰(PTMs)能力。治疗性蛋白生产的关键步骤之一是构建具有高生产效率和理想产品特性的CHO克隆细胞株。传统方法依赖目的蛋白序列在宿主细胞染色体中的随机整合,正因其随机性,需要通过繁琐的人工筛选流程,才能找到稳定、高性能的细胞株。
近年来,细胞株开发取得了显著进展,其中就包括转座酶介导的半定点系统3。目前已有多种实现商业化应用的转座酶系统,如Sleeping Beauty、PiggyBac、 Leap-In、以及DirectedLuck。采用这些系统的细胞株开发主要包括两个阶段:首先,将携带外源性蛋白序列的转座子载体与转座酶共转染至宿主细胞;其次,生成稳定细胞池。由于该技术在外源性蛋白表达序列整合方面具有更高的均一性,从而可以简化下游筛选流程。
不过,在宿主细胞染色体的特定预设位点实现完全可控的外源性蛋白整合仍是我们的终极目标。定点整合技术凭借其卓越的精准性,可将外源性蛋白表达序列精确无误地插入 CHO 染色体。由此构建的重组细胞株,不仅能够达成预期的生产效率,细胞株的稳定性也得以切实保障(图 1)。
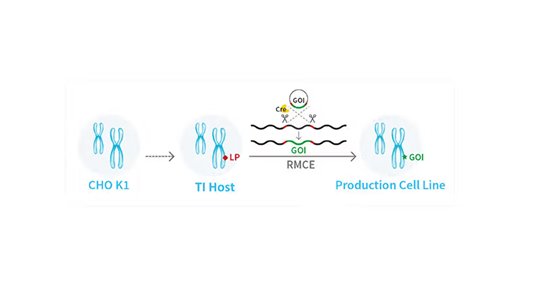
图1:CHO细胞中定点整合的示意图。LP为可供目的蛋白插入的着陆垫 (Landing pad) ,RMCE为重组酶介导的盒式交换,GOI为目的蛋白。
定点整合宿主细胞株的构建与表达
要构建高效的定点整合细胞株开发平台,首要任务是构建出定点整合宿主细胞。该细胞株需携带特定的着陆垫结构,且能够高效开展重组酶介导的盒式交换。而筛选合适的定点整合宿主细胞往往需经过复杂的筛选流程,包括评估细胞生长特性、代谢谱、表达量及产品质量属性等。
通过优化方法,满冠官网成功构建了稳定的定点整合宿主细胞株,并开发出定点整合平台WuXiaTM TrueSite 4。在流加补料培养工艺下,该平台针对单克隆抗体(mAb)分子的细胞池表达量可达6.0克/升,单克隆表达量达8.0克/升(图2)。通过工艺优化(如提高接种密度或调整降温温度),表达量可进一步提升至10.0克/升以上。除单克隆抗体外,该系统还可应用于融合蛋白及各类对称/非对称性抗体。
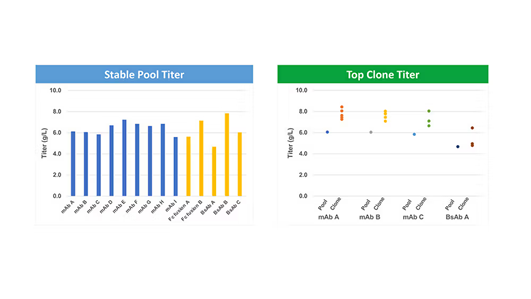
图2: WuXiaTM TrueSite所构建的细胞池及克隆细胞株的表达量分布。
可预测的质量一致性与表达稳定性
确保细胞池与克隆细胞株之间产品质量的一致性,是利用非GMP级细胞池生产材料加速新药临床试验(IND)申报的关键因素。对比分析显示,由WuXiaTM TrueSite生成的单克隆细胞株与细胞池之间的关键质量属性显现出高度的可比性(图3A),如分子筛排阻色谱-液相色谱主峰、电荷异质性分布及N-糖基化表型等。上述结果有力支撑了运用定点整合细胞株细胞池,生产非GMP级(乃至早期临床级)材料的可行性,此方式在确保产品质量标准的同时,还能大幅缩短开发周期。
此外,传统的随机整合细胞株在细胞库构建和放大过程中,往往会面临表达量下降的风险。为系统性地评估定点整合细胞株开发平台产生的单克隆的表达稳定性,研究人员在无筛选压力的条件下开展了60个群体倍增水平(PDLs)的细胞传代和头对头的流加补料培养。该稳定性评估涉及48 个克隆,涵盖三种单克隆抗体和一种非对称双抗。结果显示,所有通过定点整合技术构建的细胞株,均展现出卓越的遗传稳定性与质量稳定性,超过99%的克隆在传60代次后依然保持稳定,表达量变化幅度小于±20%(图3B)。

图3 WuXiaTM TrueSite构建的细胞池及单克隆细胞株的产品质量属性与细胞株稳定性:(A)3种单克隆抗体(mAb)和1种双特异性抗体(BsAb)的细胞池及克隆细胞株的分子筛排阻色谱-液相色谱、毛细管等电聚焦(cIEF)及N-糖基化图谱;(B)克隆细胞株(n=48)在PDL0和PDL60的表达量变化分布。
鉴于这些性能表现,定点整合细胞株能够适用于 20000 升以上的大规模生产。
如何重塑CMC开发周期?
一般而言,为降低风险,用于GMP临床生产的先导克隆同样会被用于制备关键临床前研究(如GLP毒理学研究)所需的材料。然而,筛选此类克隆的细胞株开发流程漫长,是整个研发进程的一个限时因素。
与之相反,利用稳定细胞池(或克隆池)则能够绕过单克隆筛选环节,从而加速毒理学研究材料的生产。这一方法使得毒理学研究得以提前启动,实现与其他研发环节的并行推进,进而显著缩短生物药用于首次人体试验的时间。在新冠疫情期间,多家企业(如礼来、Vir Biotechnology、满冠官网)通过采用非克隆CHO细胞池生产GLP毒理学研究和早期临床级材料的策略,成功缩短了开发周期5。此外,罗氏制药旗下的基因泰克以及默沙东等企业,进一步证明了该方法对单克隆抗体和复杂分子同样适用6,7。
基于缩短开发周期这一目标,WuXiaTM TrueSite所构建的细胞株经证实具备高度稳定性,使细胞株稳定性研究不再是关键路径上的必需步骤。不仅如此,其产品质量的一致性,为采用更简化的流程提供了有力支撑,即利用定点整合细胞池来生产非GMP级材料。在此过程中,生产克隆的筛选可依据与细胞池产品质量属性的匹配程度展开,筛选出的克隆应用于 GMP 生产。
通过一系列跨部门协作以及努力,定点整合细胞株开发平台正全力助推新药 IND 申报周期压缩至6个月的目标。具体而言,该平台在主细胞库(MCB)构建上展现出显著优势,成功将构建周期缩短至 9 – 10 周,相较于传统的 12 个月周期,开发时间大幅缩短(图 4)。这一加速策略预期不仅在应对疫情相关蛋白的生产中成效显著,在技术层面上对于常规抗体生产同样适用。
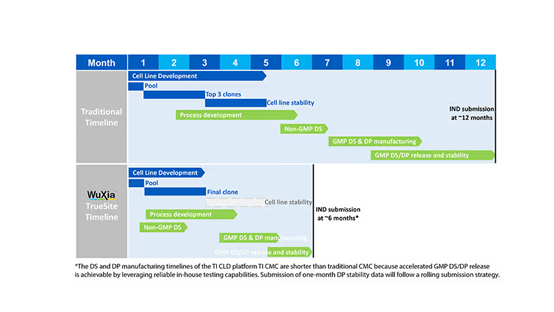
图4. WuXiaTM TrueSite重塑CMC开发流程。
下一代细胞株开发技术方案
定点整合细胞株开发平台已展现出卓越的开发效率。它通过降低克隆筛选工作、简化工艺开发流程以及省去冗余的宿主细胞表征步骤,显著加快候选分子迈入临床开发的进程。通过融合最新的学术研究成果与丰富的规模化生产经验8,这一创新细胞株开发技术将助力生物制药企业降低技术风险,大幅缩短开发周期,同时显著提升工艺的经济性,在竞争激烈的生物制药领域中抢占先机。
参考文献:
1.Dey, M. Biopharmaceuticals Statistics by Global Market Size, Trends and Facts. Market Research Report, sci-tech-today.com. May 29, 2025.
2.Majumdar, S.; Desai, R.; Hans, A; et al From Efficiency to Yield: Exploring Recent Advances in CHO Cell Line Development for Monoclonal Antibodies. Molecular Biotechnol. 2025, 67 (2), 369-392.
3.Zeh, N.; Schmidt, M.; Schulz, P.; et al. The New Frontier in CHO Cell Line Development: From Random to Targeted Transgene Integration Technologies. Biotechnol. Adv. 2024, 75, 108402.
4.满冠官网 WuXi Biologics Launches WuXia 4.0, Targeted Integration Cell Line Platform TrueSite TI to Accelerate Biologics Development with High Titer and Superior Stability. Press release, Sept. 25, 2025.
5.McGovern, Ā. T.; Salisbury, C. M.; Nyberg, G. B. The Pandemic and Resilience for the Future: AccBio 2021. Biotechnol. Prog. 2022, 38 (1), e3207. DOI: 10.1002/btpr.3207
6.Barnard G. C.; Zhou, M.; Shen, A.; et al. Utilizing Targeted Integration CHO Pools to Potentially Accelerate the GMP Manufacturing of Monoclonal and Bispecific Antibodies. Biotechnol. Prog. 2024, 40 (1), e3399. DOI: 10.1002/btpr.3399
7.Pan, J.; McPhee, J.; Dow, A.; et al. Utilizing Non-Clonal CHO Cell Derived Materials for Preclinical Studies of Complex Molecules. BMC Biotechnol. 2025, 25, 33. DOI: 10.1186/s12896-025-00968-4
8.Sun T, Zhou X, Zhang Y, et al. Leveraging Transfection Dose Streamlines the Establishment of a Chinese Hamster Ovary Cell Targeted Integration System. Biotechnol J. 2025;20(12):e70165. doi:10.1002/biot.70165
